Principe de fonctionnement des piles et batteries
Les piles
Une pile électrique est un dispositif électrochimique qui transforme l'énergie d'une réaction chimique en énergie électrique. Dans une pile les réactifs sont introduits à la fabrication, quand ils sont épuisés on doit remplacer la pile par une neuve.

Le boîtier d'une pile abrite une réaction chimique entre deux substances dont l’une peut céder facilement des électrons (matériau réducteur), et l’autre qui les absorbe (matériau oxydant). Une telle réaction est appelée une oxydo-réduction. Chaque élément du couple oxydant/réducteur est relié à une électrode. Ces électrodes, lorsqu'elles sont reliées à un consommateur électrique, provoquent la circulation d'un courant électrique ; la réaction chimique provoque une circulation de charges (électrons, ions). Une pile fournit donc du courant continu.
- la borne (-) d'une pile correspond à l'anode où se produit la réaction d'oxydation qui va fournir les électrons.
- la borne (+) d'une pile correspond à la cathode où se produit la réaction de réduction qui va consommer les électrons.
Ce système est utilisé pour les piles électriques et les batteries d'accumulateurs, avec divers couples électrochimiques. Une pile électrique peut contenir plusieurs de ces couples montés en série, ce qui permet d'augmenter la tension disponible aux bornes de la pile.
Réaction d’oxydo-réduction dans un élément de la pile Volta :
\(Zn \rightarrow Zn^{2+} + 2e-\) \(Cu^{2+} + 2e- \rightarrow Cu\)
Dans une réaction d’oxydo-réduction, il y a un corps réducteur qui cède des électrons, ce corps est oxydé (ici le zinc) et un corps oxydant qui prend des électrons et est réduit (ici le cuivre).
Une pile est essentiellement caractérisée par sa tension nominale, dont la valeur dépend du couple rédox utilisé et du nombre d’éléments insérés dans la pile.
- La pile saline : L’électrolyte est une solution de chlorure d’ammonium et l’électrode négative est en zinc.
- La pile alcaline : L’électrolyte est une solution de potasse (alcaline signifie basique).
- La pile au lithium : l’électrode négative est en lithium.
Les batteries d’accumulateurs
Un accumulateur électrique, est un dispositif destiné à stocker l'énergie électrique, sous forme électrique (condensateur) ou accumulateurs électrochimiques, parfois appelés à tort pile rechargeable. L’accumulateur électrochimique permet de façon réversible de transformer l’énergie chimique d’oxydoréduction en énergie électrique. Lors de la charge, on réalise une électrolyse. Il fonctionne en récepteur et absorbe de l’énergie électrique qu’il transforme en énergie chimique stockée. Lors de la décharge, il se comporte comme une pile. Il fonctionne en générateur et transforme l’énergie chimique en énergie électrique. Les accumulateurs peuvent subir un nombre limité de cycle charge-décharge.
Il existe plusieurs couples oxydo-réducteurs utilisés :
| Technologie | Electrodes | Avantages | Inconvénients |
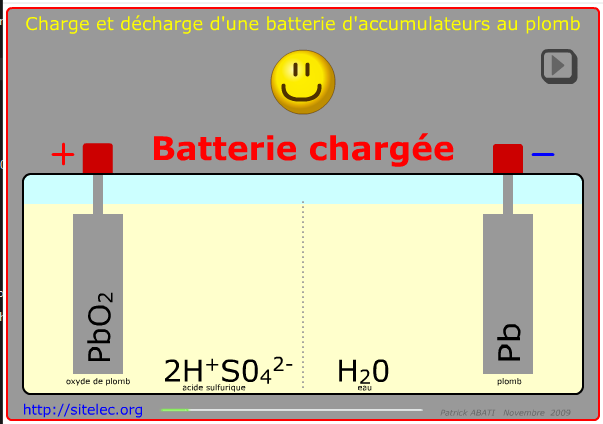
| plomb-acide | + : PbO2
- : Pb Electrolyte :H2SO4. | Peu onéreux | supporte mal les décharges profondes |
| nickel-cadnium | + : NiO(OH)
- : cadmium KOH. Electrolyte : KOH | supporte des pointes de courant cycles > Li-ion > Ni-MH | effet mémoire
stockée déchargée décharge naturelle rapide cadmium est très polluant |
| nickel-métal-hydrure | + :Ni | peu polluant.
énergie massique est supérieure de 40 % à celle des Ni-Cd effet mémoire est très faible. | |
| Nickel Zinc | supporte des pointes de courant
Robuste, fiable Nbre cycles = NiCd, autodécharge et son effet mémoire sont inférieurs. fabrication plus économique que les autres accumulateurs alcalins (NiCd et NiMH). aucun métal lourd, aisément et intégralement recyclable | ||
| Lithium Ion | + :
- : Li | Fort potentiel/ légère | problèmes de sécurité demeurent (prise de feu)
durée de vie 2-3 ans indépendant de l’utilisation |
| Lithium polymère |
Caractéristiques des piles et accumulateurs
Force électromotrice, résistance interne :
Fixée par le potentiel d'oxydo-réduction du couple redox utilisé, elle est de l'ordre de quelques volts pour un élément. Comme en pratique des tensions plus élevées, typiquement 12, 24 voire 48 V et plus sont requise, il suffit pour augmenter la tension de raccorder des éléments du même type en série au sein d'une batterie d'accumulateurs. La tension aux bornes de la pile est de la forme \({U_{PN}} = E - rI\) . La tension indiquée sur le boîtier est celle de sa fem E, quand aucun courant n’est débité. La résistance interne est de l’ordre du dixième d’ohm. Cette fem varie en fonction de la durée d’utilisation. On dit que la pile se décharge.
Prise en compte de la résistance d’autodécharge et de la résistance série :
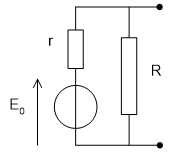
| \({U_{PN}} = E_0 - rI\) |
Capacité d’une pile : c’est la valeur absolue de la charge électrique totale qu’elle peut fournir exprimée en Ah (mais l'unité officielle (SI) est le coulomb (1 A.s)).
Une batterie de 1Ah se décharge en 1h sous un courant de 1A, en 2h sous un courant de 0.5A, etc
| \(Q = I \times t\) |
- C en A.h ;
- I intensité en A ;
- t durée totale de fonctionnement en h.
La capacité dépend du courant de décharge : plus on décharge vite moins la capacité est importante. On parle de I10 : décharge de l’accu en 10 h 1A.h = 3600C
Un accu présentant une capacité C20 = 100 Ah signifie que l’on dispose de 100 Ah si l’on décharge la batterie en 20 h soit avec un courant de 5 ampères.
Energie disponible :
exprimé en W.h.
1W.h=3600J Pour comparer les diverses piles, il faut calculer l’énergie massique en W.h/kg ou l’énergie volumique en W.h/cm3. Ces définitions restent valables pour les accumulateurs.
Puissance en W : Puissance maximale que la batterie peut fournir – il faut préciser pendant combien de temps (en général 10 s) et distinguer « en charge » ou « en décharge »
Rapport P/E : rapport entre la puissance et l’énergie de la batterie. Il existe des batteries typées « Energie » et d’autre typées « Puissance »
- VE : puissance 80 kW, énergie embarquée 40 kWh : P/E = 2 → batterie d’énergie
- VEH : puissance 80 kW, énergie embarquée 2 kWh : P/E = 40 → batterie de puissance
Etat de charge en % (SOC = State of Charge) :rapport de la capacité actuelle en Ah à la capacité initiale SOC = 100 % : batterie chargée
Profondeur de décharge en % (DOD = depth of discharge) :DOD = 1 – SOC DOD = 100 % : batterie déchargée
Régime de courant (1C, 2C, C/2, etc…): Valeur du courant de la batterie exprimée par rapport à la capacité. 1C est le courant qui décharge la batterie en 1h, 2C est le double Exemple pour une batterie de 8Ah : 1C = 8A ; 2C = 16A ; C/2 = 4A (en charge ou en décharge)
Rendement faradique \(\eta_F\) :
- Ah déchargés / Ah chargés
- dépend du SOC
Lithium ion : \(\eta_F \approx 1\)
Rendement énergétique \(\eta_e\)
- énergie récupérée / énergie fournie
- inférieur au rendement faradique
(effet de l’impédance interne)

Caractéristiques des piles et accumulateurs


Conditions optimales d’utilisation d’une batterie
Couplage des batteries
Afin de garantir
- le besoin en tension, les batteries peuvent être mises en série. Leurs tensions s’additionnent
- le besoin en courant, les batteries seront montées en parallèle. Les courants de chaque branche s’ajoutent.
Surveillance des batteries
Un batterie ne fonctionne bien que si toutes les cellule sont dans le même état (tension, SOC…) Afin d’exploiter aux mieux une batterie, un « boitier intelligent » peut permettre la surveillance active : le BMS« Battery Management System » de divers paramètres
- Surveillance de la tension et de la température de chaque élément de la batterie
- Calcul du SOC de la batterie et/ou de chaque élément
- Calcul des indicateurs
- SOH (state of health),
- SOF (state of function),
- SOE (state of energy)
- Supervision de l’équilibrage des éléments
- Délestage éventuel de modules de la batterie (si mise en parallèle)
Autonomie des batteries
Le SOC (State Of Charge =Energie disponible) de la batterie nous renseigne sur l’énergie disponible. En cas d’usage de celle-ci, le SOC diminue d’autant plus vite que la puissance demandée est importante : \(SOC_{final} = SOC_{initial} - P \times t\)
liens
TP works d'A. Chelouah sur les piles
Introduction
Des caractéristiques de piles : https://www.all-batteries.fr/pile.html
C'est pas sorcier -PILES ET BATTERIES : les sorciers se mettent au courant 26' https://youtu.be/mItO3l82Ic0
Comment c'est fait : Les Batteries au lithium
https://www.youtube.com/watch?v=NL2CRNAeTLg
Les batteries lithium-ion
Les batteries utilisées couramment dans les véhicules électriques,mais également dans d’autres applications comme les téléphones portables,sont de type lithium-ion. Elles présentent l’avantage d’une très grande énergie massique comprise entre \( 90 Wh·kg^{-1} \) et \( 180 Wh·kg^{-1} \). De plus, ces batteries, même partiellement déchargées, délivrent toujours la même puissance, permettant une utilisation dans les mêmes conditions quel que soit le niveau de charge.
L'équilibrage des batteries
| https://youtu.be/AUOSuwA1kNU |
Le vieillissement des batteries
| https://youtu.be/4BeyL_KJarc |