Les transitions des divers états
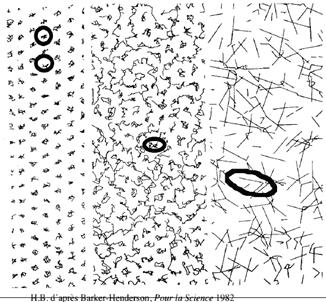
Lorsqu’on chauffe un solide (tel que la glace ou l’acier), ses atomes ou ses molécules reçoivent de l’énergie cinétique sous forme d’un mouvement vibratoire désordonné : ils oscillent plus vigoureusement autour de leurs positions d’équilibre.
Si l’énergie reçue est suffisante pour surmonter les forces intermoléculaires, le solide fond. A l’état liquide de la substance, de petits groupements de molécules associés persistent, mais ils se font et se défont au gré des déplacements de l’échantillon. Il y a de l’ordre, mais il est local et changeant. Les molécules restent relativement proches les unes des autres et interagissent sensiblement, mais la liaison puissante et rigide du solide a disparu.
En élevant encore la température, le liquide se rapproche de son point d’ébullition ; les liens entre les molécules finissent alors par céder. L’énergie cinétique thermique aléatoire de certaines molécules dépasse alors l’énergie potentielle de cohésion ; elles s’échappent en groupe du liquide. Les agrégats locaux se désagrègent et le liquide s’évapore : il devient un gaz
Représentation du mouvement moléculaire des divers états
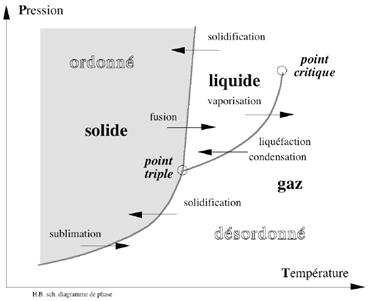
Diagramme de phase d’une substance ordinaire, ou diagramme de Clapeyron
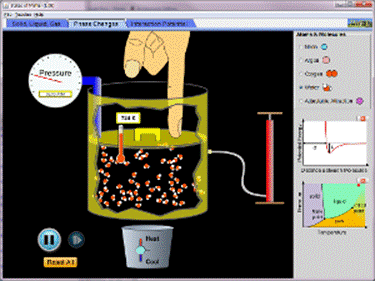
http://phet.colorado.edu/en/simulation/states-of-matter
http://phet.colorado.edu/en/simulation/states-of-matter-basics
Physique - Changements d'état Swisslearn (15'25)
https://www.youtube.com/watch?v=IQGVCRcWp4U
Ebullition de l'eau à basse température (2'28")
https://www.youtube.com/watch?v=8n9CyYfKGts